Todo medicamento, antes de ser comercializado, passa por um longo e complexo processo chamado de Pesquisa Clínica, que tem o objetivo de avaliar sua segurança e eficácia. Após diversos estudos e testes, a Agência Nacional de Vigilância Sanitária (Anvisa) analisa os resultados, faz aprovações regulatórias éticas e sanitárias e irá conceder ou não o registro para que o medicamento chegue ao mercado.
A realização de todas as etapas da Pesquisa Clínica somente é possível com o auxílio de voluntários, pois testes devem ser realizados em humanos. São várias fases consecutivas, dependendo da pesquisa, com pessoas sadias ou que já foram acometidas por alguma enfermidade, entre elas o câncer de mama.
Contribuindo com os estudos, o paciente terá diversos benefícios, como o acesso a medicamentos inovadores e que ainda não estão disponíveis no SUS ou nas farmácias, direito a consultas programadas e monitoramento rigoroso das condições de saúde sem custo durante o período do estudo. É importante lembrar que também existem riscos, como efeitos colaterais e a possibilidade de o medicamento não ser eficaz. Caso hajam efeitos adversos durante a pesquisa, os mesmos serão registrados e tratados no mesmo momento. O tratamento pode ser interrompido e depois retomado ou pode ser suspenso permanente.
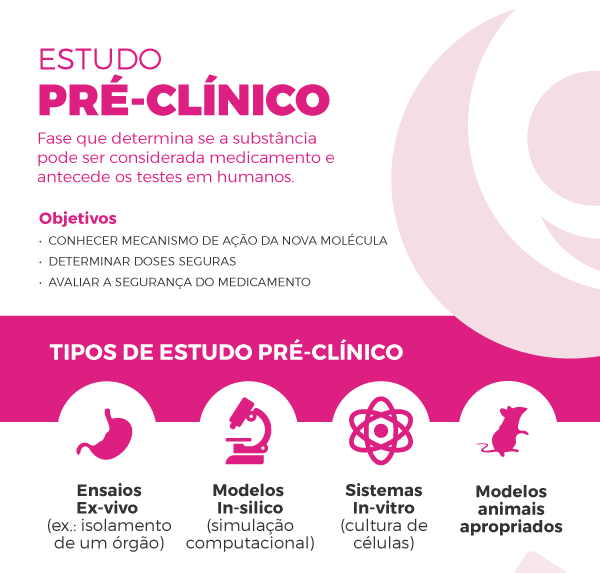
A Pesquisa Clínica é de extrema importância para a descoberta de novas possibilidades de cura, para garantir a segurança dos pacientes e para assegurar a real eficácia dos medicamentos. Por isso, a FEMAMA não apoia que medicamentos sejam liberados para uso de pacientes em geral sem passar por esse rigoroso processo, a exemplo da fosfoetanolamina, que passou apenas pelo estudo pré-clínico, sem ter sido testada em humanos.
Entenda como funcionam as etapas da Pesquisa Clínica de novos medicamentos:






